1. はじめに脳卒中をめぐる状況
脳血管疾患(脳の血管の梗塞や出血)は、全世界で毎年13.7百万人が発症し、そのうち5百万人の命を奪っている。また、一命をとりとめても片麻痺などの後遺症が残ることが多く、有病者数は80百万人にも上る、人類にとっての重大疾患である1。日本国内においても、平成26年時点で高齢者の入院受療率が高い主な傷病として悪性新生物を抑えて脳血管疾患が第1位であり2、発症者数は高止まりとなっている。幸いにも急性期における死亡率は1995年から平成2015年までの20年間で半分以下となっているが3、現在直面しているのは、「発症後のリハビリテーション治療」の質を如何にあげるか、という課題である。
脳卒中によって引き起こされる障害は運動障害だけでなく、視野が狭くなったり食べ物を飲み込みにくくなる嚥下障害のほか、記憶障害や注意障害などの高次脳機能に影響を及ぼす障害まで多岐にわたるため、患者の日常生活の質に与える影響は極めて大きい。これらの障害に対する劇的な治療薬は確立されていないが、発症後のリハビリテーションを通じて神経系が持つ可塑性(訓練などによって変化しそれが維持される機能)を利用することで、本人と医療スタッフの努力により機能回復が期待できる。時間はかかるが希望があるプロセス、それがリハビリテーションというユニークな医療領域である。
2. 重要性は上がる一方で成果がついてきていない
脳卒中リハビリテーションの重要性が高まる一方で、医療経済的な観点から見ると治療の効率性には課題がありそうだ。
日本国内では脳卒中患者数は一貫して減少傾向であるにも関わらず、2016年度に1兆7,739億円、2017年度には1兆8,085億円が脳血管疾患に対する医療費として支出されており4、1996年度と比べると2017年度の患者当りの医療費は2倍近くに増加していることが分かる5(図1)。
図 1:患者千人当たりの疾患別医療費(循環器系の疾患は脳血管疾患を含む)

※ 平成29年(2017)患者調査の概況, 厚生労働省、平成7年(1996)患者調査の概況, 厚生労働省 のデータを基に作成
こうした医療費の増加は、上述のように急性期の死亡率の低下との関係が推定される一方で、リハビリ治療の質を表す重要指標である「自宅復帰率」の側面からは課題が見えてくる。
脳卒中などの発症によって急性期治療を受けた後、回復期病棟に入棟したリハビリ対象患者のうち、病棟から自宅への復帰率は平成1999年から2015年までの16年間で60.7%から67.8%、自宅・施設を含む在宅復帰率は2013年から2015年までの3年間で78.7%から78.3%と頭打ちである6 。過去10年以上にわたり、リハビリテーションのアウトカムは決して低くないが、かといって著しい発展は見られない(図 2)。
リハビリテーションにおいては、生活動作を自立的に行えるようになることで、病棟から自宅や介護老人保健施設への復帰が1つの目標になる。しかし、依然として30%程度の方は自宅に復帰することができず、継続的なリハビリテーションや介助を受けながらの生活を余儀なくされている。
図 2:脳血管疾患を原因疾患とする、入院受療率に対するリハビリテーション後の在宅復帰率の推移
(在宅復帰率は2015~2017年度のみ)
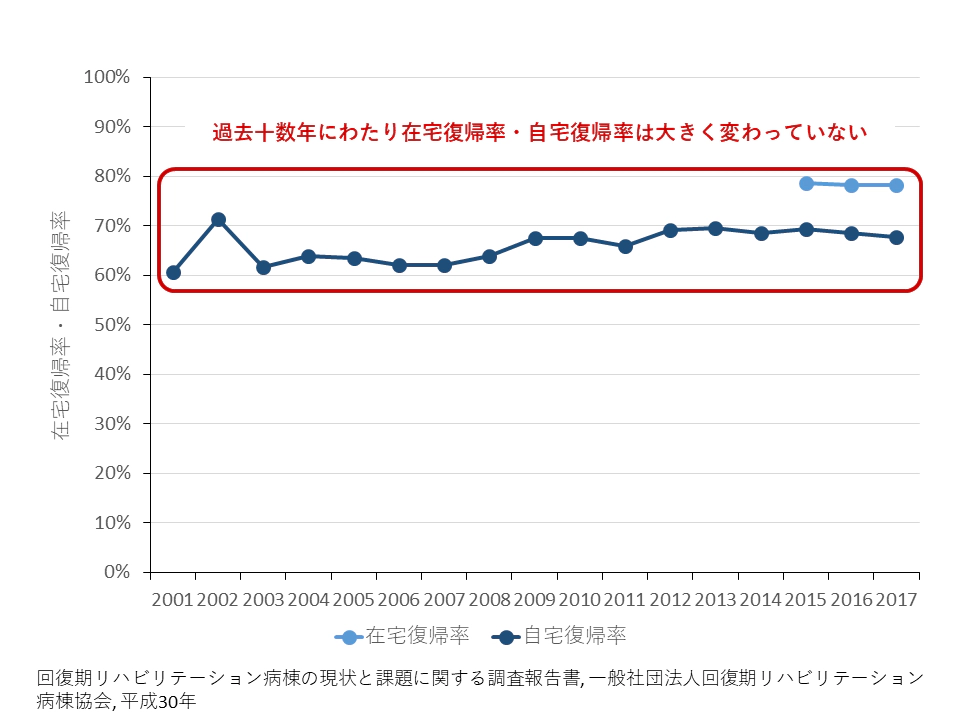
※ 「回復期リハビリテーション病棟の現状と課題に関する調査報告書, 一般社団法人回復期リハビリテーション病棟協会, 平成30年」を基に作成
では、これが現代リハビリテーション医学の天井で、これ以上の成長はないのだろうか。
明確なエビデンスがあるわけではないが、リハビリは「アート」とも形容されるような、俗人的かつ不可知的なプロセスである。また、患者の病態や生活環境が多様であり、効果的なリハビリテーション技術の標準化や普及が困難である点も指摘される。こうした要素が、依然として長期化が指摘されるリハビリテーション入院期間及び医療費高止まりの要因になっているとも考えられる。これらの要因に対する下記のような先端科学のアプローチが、成熟したかに見えるリハビリ医療にブレイクスルーを起こす可能性があると著者は考えている。
すなわち
- 神経科学の技術に基づく新たなリハビリテーション介入(ニューロテクノロジー)
- リハビリ治療プロセスの定量的なデータ化及び最適化(デジタル化)
である。
本稿では、今後も全世界的に需要が増加することが予想される脳血管疾患などのリハビリテーションにおける現状・課題を考察した上で、医療費負担の最適化に寄与する個別化医療と治療アウトカム最大化に向けた方策について構想と提言を行いたい。
3.回復期リハビリテーションの現状
発症後のリハビリテーションを必要とすることが多い脳血管疾患及び整形疾患のステージは急性期・回復期・維持期の3つに分類される7 (図 3)。中でも重要な役割を果たすのが、アウトカムの改善余地が高く、発症後最大6カ月間をカバーすることから一定の患者数が存在する回復期である。回復期リハビリテーションの最近の動向としては「アウトカム重視の診療報酬制度」「リハビリテーション回数上限設定」「自費リハビリテーションの増加」の3点が挙げられる。
図 3:リハビリテーションの役割分担
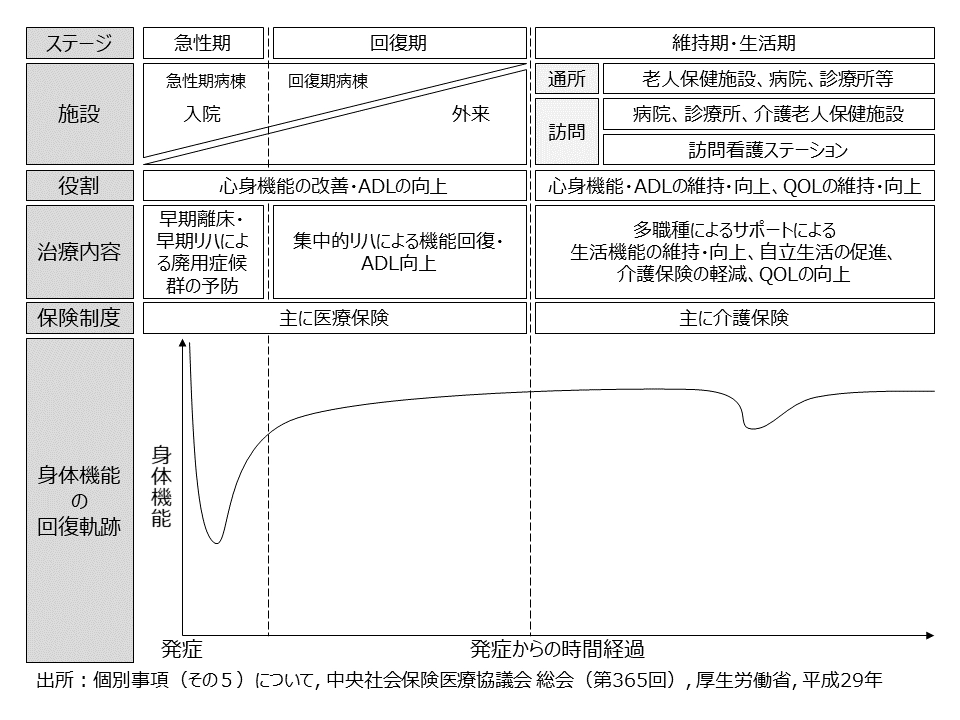
※ 2017年年中央社会保険医療協議会 総会(第365回)資料を基に作成
一つ目の特徴として、アウトカム重視の診療報酬制度への転換があげられる。日本国内では、主に回復期リハビリテーション病棟が回復期におけるリハビリテーション機能を担っている。2000年から2014年にかけて病床数が65倍程度まで急激に量的拡大8したことやリハビリテーションに係る医療費の拡大を受け、平成28年度の診療報酬改定から国は治療成果としてのアウトカムを重視した診療報酬制度設計を行っている。アウトカム重視の制度設計として、アウトカムの改善度合いや要員配置などの施設基準を満たした病棟はより高い入院料やリハビリによる点数加算を受けることができる。また、令和2年度の診療報酬改定により、治療効率の向上に寄与すると認められたロボットなどのリハビリテーション機器を用いたリハビリテーションについて、僅かながら別途保険点数を加算することができるようになった。従前は治療機器の使用の是非に関わらず20分/1単位のリハビリテーション治療の点数は一定であり、先進的な一部の施設のみがロボットなどの先進機器の導入を進めていた。指定の治療機器については、導入費用の保険収載によって部分的にも償還が可能になったことで、今後は中小規模の臨床現場にも治療効果の高い機器導入が進むことが考えられる9。
二つ目の特徴として、リハビリテーション回数の上限設定があげられる。回復期リハビリテーション病棟において、リハビリ治療を担うのは国家試験に合格したセラピスト(Physical Therapist:理学療法士、Occupational Therapist:作業療法士、Speech-Language-Hearing Therapist:言語聴覚療法士)であるが、診療報酬を請求可能なリハビリテーションは患者単位で上限単位が設定されているだけでなく、セラピスト単位で週毎に上限回数が設定されている。患者は20分/1単位のリハビリテーションを1日上限9回、最大で3時間受けることができるが、それ以上リハビリテーションを行っても診療報酬制度上は点数が加算されない。現場のセラピストは限られた治療時間の中で効果を最大化させるために、自腹でリハビリテーション技術を学ぶための講習に参加するなど自己研鑽に励む他ない。その一方で、上限設定のせいでセラピストの努力を本人の報酬として還元する仕組みがなく、そもそもリハビリーションの品質が下がらざるを得ない制度設計とも言える。
三つ目の特徴として、患者側がリハビリテーション病棟を選ぶ動きも盛んになっていることが挙げられる。中でも特徴的な傾向として、自費リハビリテーション施設の増加があげられる。自費リハビリテーション施設とは、診療報酬の枠外でリハビリテーションを提供する施設であり、上限単位に縛られず高度なリハビリテーションを受診することで自費負担をしてでも運動機能回復を願う患者の受け皿となっている。株式会社ワイズが運営する脳梗塞リハビリセンターは、全16回(1回150分)の自費リハビリを総額275,000円で提供している。高額な格設定ながら、2014年の事業開始以来20拠点以上を展開するまで事業拡大している。10しかし、2018年時点で複数の施設で利用待ちが続いており、診療報酬の枠内では満足できない患者の根強いニーズが伺える11。大手では2018年に豊田通商グループの株式会社豊通オールライフが自費リハビリ事業に参入した他12、徒手療法の“川平法”で著名な川平和美氏が開設した川平リハラボなど、独自の治療メソッドを軸に展開する機関も数多く存在する13。
4.アウトカム最大化の実現に向けた課題と糸口
アウトカム重視の流れは前述のとおりだが、リハビリにおける患者の願いは非常に多様である。自立歩行といった、患者共通で重視される機能もあるが、例えば脳卒中になってしまった校長先生が卒業式の時だけ立ってスピーチをしたいと願う場合には、起立状態を保持できる下肢機能を優先する方がいいかもしれない。また、海釣りやアイドルのライブが何よりの生きがいの患者であれば、釣り竿やペンライトを振れるよう、上肢機能の改善を優先する必要があるかもしれない。
そして何より、個人ごとの病態は多種多様である。脳の損傷部位から、その人の生きざま(QOL)まで極めて多層で、また、層の中でも多様性がかなりある(図 4)。特定の疾患原因がある感染症などとは大きくことなる点がリハビリテーションの難しいところであり、このような複雑な状況の中でどうすればアウトカムを最大化するのかは、チャレンジングな課題である。
解決の糸口として「どんな患者」が「どんな介入」をすると「どんなアウトカム」になるか、この一連の流れを定量的・科学的に分析し、最適化に努めることが極めて重要になるが、簡単ではない。
いくつか課題を順番に見ていく。
図4:脳構造~日常生活までのリハビリに関わる病態の多層構造

課題①リハビリのプロセスに関わる客観性と可用性の課題
まず、患者の状態やアウトカムを評価する「評価尺度」に関する課題として、尺度の客観性の担保が困難であることが上げられる。リハビリテーションにおける評価尺度は、世界的にADL(Activities of Daily Living)が用いられており、これは食事や排泄など、人間が生活する上で毎日行う必要のある基本的な日常生活動作の可能な度合いを評価する。日本の診療報酬制度では、回復期においては18項目7段階スケールのFIM(Functional Independence Measure)によって各病棟の治療実績を評価しているが14、スケールの多寡や上肢・下肢に特化した項目の有無によって、数多くのアウトカム評価指標が存在する(図 5)。なお、国内の介護リハビリテーションなど、維持期の評価指標としては、FIMよりも簡易な10項目3段階スケールのBI:Barthel Indexが用いられる。
図5:FIMの評価項目
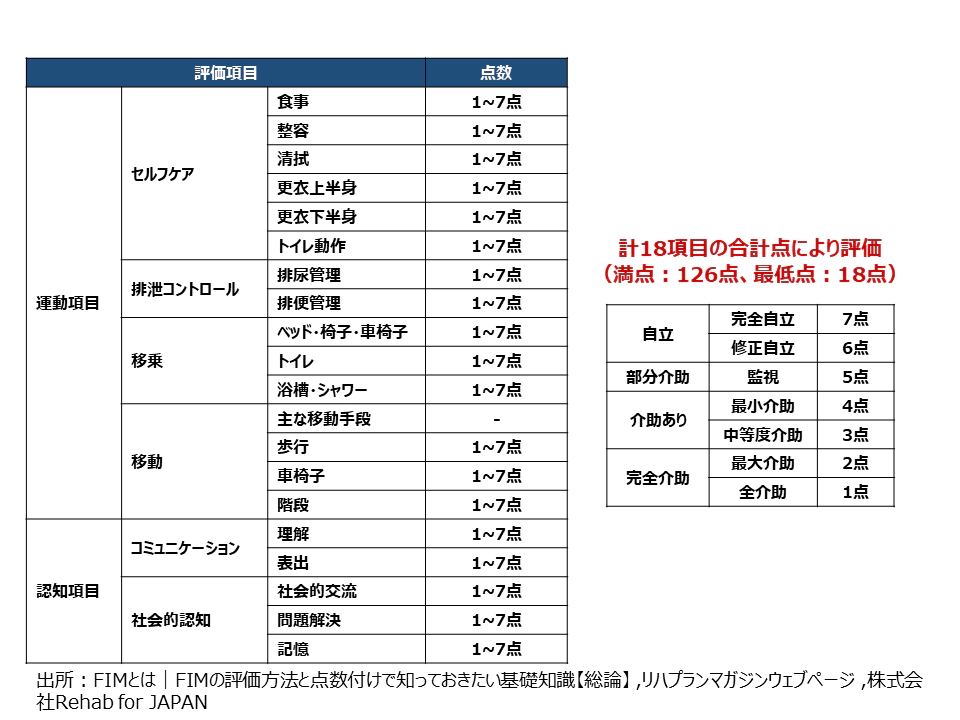
※ 株式会社Rehab for JAPANリハプランマガジンウェブページを基に作成
FIMによるADL評価は7歳以上のどのような病態の患者にも用いることができるだけでなく、医療従事者でなくても利用できる汎用性の高さが利点であるが、問題点としては、尺度としての客観性の担保が困難であることが指摘されている。例えば回復期病棟におけるADLの採点は国家資格を保持するセラピストが行うが、どの程度の割合で自立的に動作を行ったかについてはどうしても主観に頼らざるを得ない部分がある。また、「できるADL」ではなく実際に「しているADL」を計測することが原則となっているが、麻痺の残る患側で動作を行うか、麻痺の無い健側で動作を行うかについては規定されていないため、いわゆる「代償」を行って健側による動作を行った場合、運動機能が全く改善されない患側が動かない状態であっても数字上のADLは改善することになる。
上述の通り、ADLの改善度合いによって回復期病棟の施設基準が決まり、保険点数を増減させるため、病院経営上はADL改善を大きく見せることにインセンティブがある。一般社団法人回復期リハビリテーション病棟協会が国内の回復期病棟を対象に実施した調査によると、診療報酬改定によってADLの一指標であるFIMの実績指数評価が導入された2016年度以降、なぜか入棟時のADLが顕著に低下する傾向が見られている15(図 6)。一部の回復期病棟では急性期病棟から従来よりも早期に患者を受け入れているという指摘の他、患者の入棟時ADLを恣意的に低く評価することで、最終的な患者のADL改善度合いであるFIM利得(=退棟時FIM−入棟時FIM)を大きく見せている可能性があることが指摘されている。
図6:回復期病棟における入退棟時FIMの経年変化
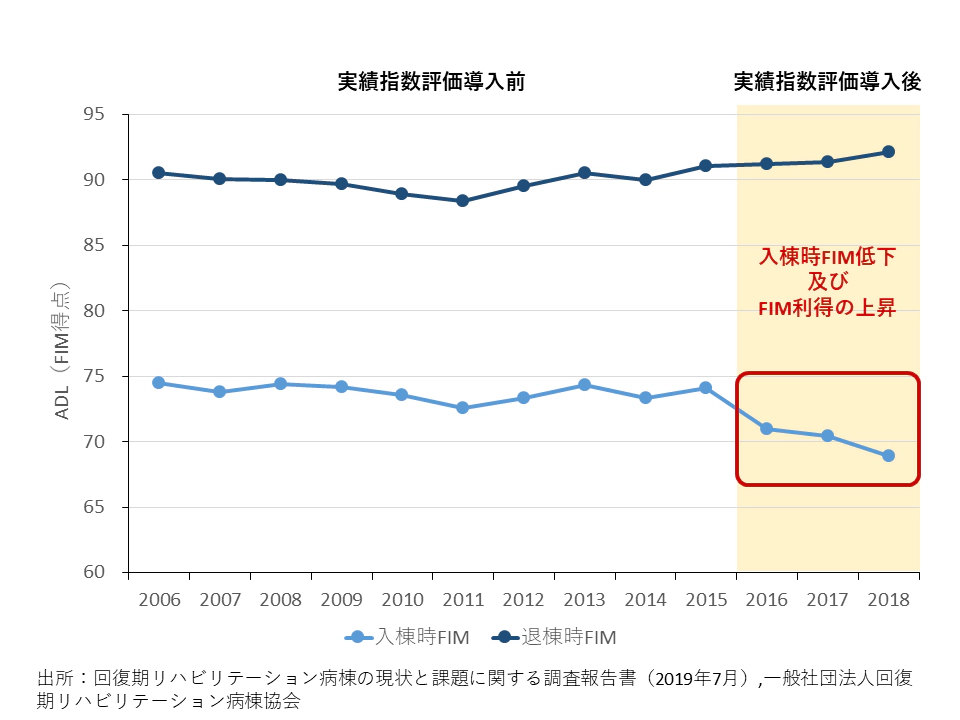
※ 2019年9月5日中央社会保険医療協議会入院分科会資料より作成
また、ADLはカテゴリカルな評価指標であるため、全く日常動作ができない患者群を一律に最低得点群として扱ってしまう“床効果”、逆に少し麻痺が残っていても日常動作ができる患者群は一律に最高得点群として扱う“天井効果”が問題点として指摘されている16。すなわち、床効果によって、実は少しずつ改善が見られる患者を「変化なし」と評価してしまう可能性や、天井効果によって通常のリハビリテーションから更なる改善を目指す患者の動機付けを失なわせてしまう可能性がある。
こうした指標の客観性の課題だけでなく、そもそも「データがない」ものも多い。特に介入のプロセスにおけるデータの可用性は極めて低い。つまり、「どんなリハビリテーションをどのくらいやったのか」のデータが現状ではほぼ入手不可能で、「歩行練習」や「上肢訓練」などはアナログでざっくりとカルテに記載される程度である。そのため、どんな加療内容がアウトカムに結びつくのか分析することは困難である。
課題②病態の多様性
2点目の課題は、脳卒中後麻痺の「病態」は患者のゴールも含めて多様であり、「答えが一つでない」のがリハの特徴であり難しさであるのは上述の通りである。
とは言え、リハビリテーションの開始時点で、最終的にその患者がどれだけの改善を期待できるかはある程度予測できる。脳卒中後の予後については発症直後の機能残存程度に応じて、発症前の70%までは時間経過に伴って回復するとされるproportional recovery ruleが原則になっている。
ただ必ずしも回復過程は一様ではなく、2020年に発表された412名の脳卒中患者を対象とした研究によると、発症直後の機能障害に関する臨床スコアを用いて、回復の経過によって患者を5つのサブグループに分類できることが示されている17(図7)。異なる予後が期待される患者に対しては異なるゴールを設定した上で、個別最適なアプローチをとることがアウトカム最大化につながるはずだが、現状では浸透していない。
またアウトカム=ゴールの指標についても、課題①でみたように個別化は難しく、人の日常生活上必要と思われる共通的な評価項目が設定されている。ただ、運転動作などの、より高次な動作を評価する指標としてIADL(Instrumental Activities of Daily Living)があり、実際のドライビングテストと合わせて作業療法を中心に用いられることがある18。しかしながら、こうした個人の状況に応じた複雑な指標は扱いの煩雑さから現場ではなかなか浸透しない。
このように、スタート地点もゴール地点も回復過程も異なる多様な患者に対して、現状では個別最適なアプローチを科学的に行うことは困難である。
図7:患者群による予後の違い
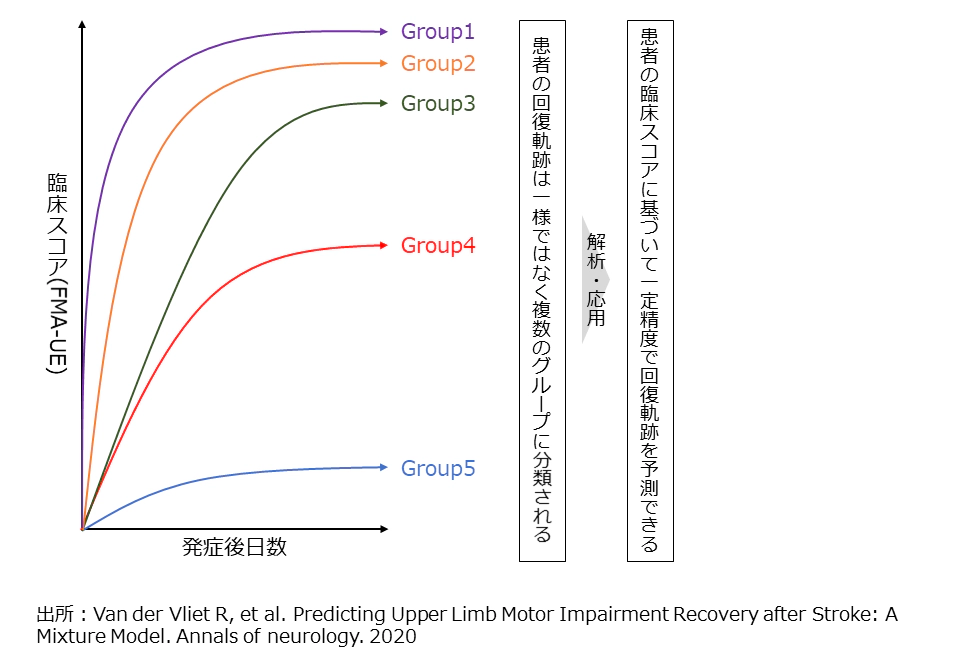
※ Van der Vliet R, et al. Predicting Upper Limb Motor Impairment Recovery after Stroke: A Mixture Model. Annals of neurology. 2020を基に作成
課題③効果的な介入方法
3点目は「介入」に関する課題である。リハビリテーションにおいて、患者の病態に応じて最終的なアウトカムを最大化するための介入方法を取り扱う科学的な研究事例は意外にも少ない。
つまり「どんな患者にどんな介入=リハビリを行うと一番予後がよくなるのか」という介入方法があるようで無いのだ。
特に、主に上肢機能を対象とする作業療法においては、理学療法に関する論文数に対して17分の1ほどの乖離があることが指摘されている19。臨床現場のセラピストが脳血管疾患のリハビリテーションにおいて介入方法の拠り所としているのは、日本脳卒中学会が制定する「脳卒中治療ガイドライン」20の他、日本理学療法士学会の「理学療法ガイドライン」21、日本作業療法士協会「作業療法ガイドライン」22であるが、ここでは主要な介入方法のエビデンスグレードを示しているが、多様な介入方法を細かく網羅しているわけではない。また、どの部位をどのように、何の道具を用いて行うかといった実践的な内容は各セラピストに委ねられている。
各介入方法の有効性が十分に示されていない背景として、これまで述べたように「評価尺度」の客観性担保が困難であることと、患者の「病態」や「ゴール」が多様であるため、ランダム化比較試験などを行う際にもサンプル数の担保などが難しいことが理由になっていると考えられる。また、研究対象を一定の基準で採用・除外する閾値についても、研究によって多様で明確に示されないことも少なくない。作業療法においては、個別患者の望むのが「海釣り」なのか「アイドルのライブ」なのかなどの個別の目標を設定し、異なる介入を行うことから、一定規模のデータ数を取得することが困難であることが考えられる。全体として、リハビリテーションの介入効果はシステマチックな比較研究が難しいため、有効性が不可知となっている介入が少なくない。
また、介入自体もセラピストによって一意ではない。例えば、回復期病棟では「運動器リハビリテーション料」が実施単位数に応じて保険収載として可能であるが、特定の患者に対する運動器リハビリテーションの内容・負荷・時間はセラピストによって異なる。エアロバイクなどの訓練機器の併用是非・負荷の設定量・実施時間は各セラピストに委ねられていることが多いため、リハビリテーションの品質にばらつきが生じやすい。こうしたリハビリテーションの内容は、上述の講習会などで学ぶ他、自主的に論文を読み込むなど独学で学習する以外に、大多数は最初にセラピストとして採用された病棟における流儀やアプローチを教え込まれて自らの方法論として確立することになる。こうした方法論は病棟によって個性が異なるため、ある回復期病棟では原則新卒セラピストのみを採用するなど、各病棟の差別化の根拠となっている。
このように脳血管疾患における回復期リハビリテーションのアウトカムを向上していくには課題が山積しており、特定の患者を適切な指標で評価し、その個別性に対応した介入戦略を立案できないことが、上述のような、なかなか下がらない在宅復帰率や医療費の高止まりの要因になっているとも考える。
5.ニューロテクノロジー(Neurotechnology)の応用と
デジタル技術の活用による課題解決
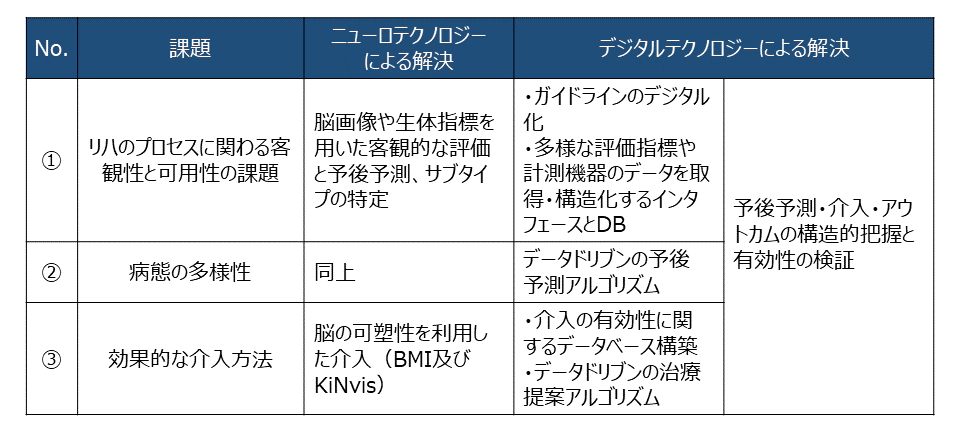
上述の課題解決に資する方策として、我々は「脳神経科学(ニューロテクノロジー)」「デジタル」の2点に着目している(表 1)。
表 1:課題解決の全体像
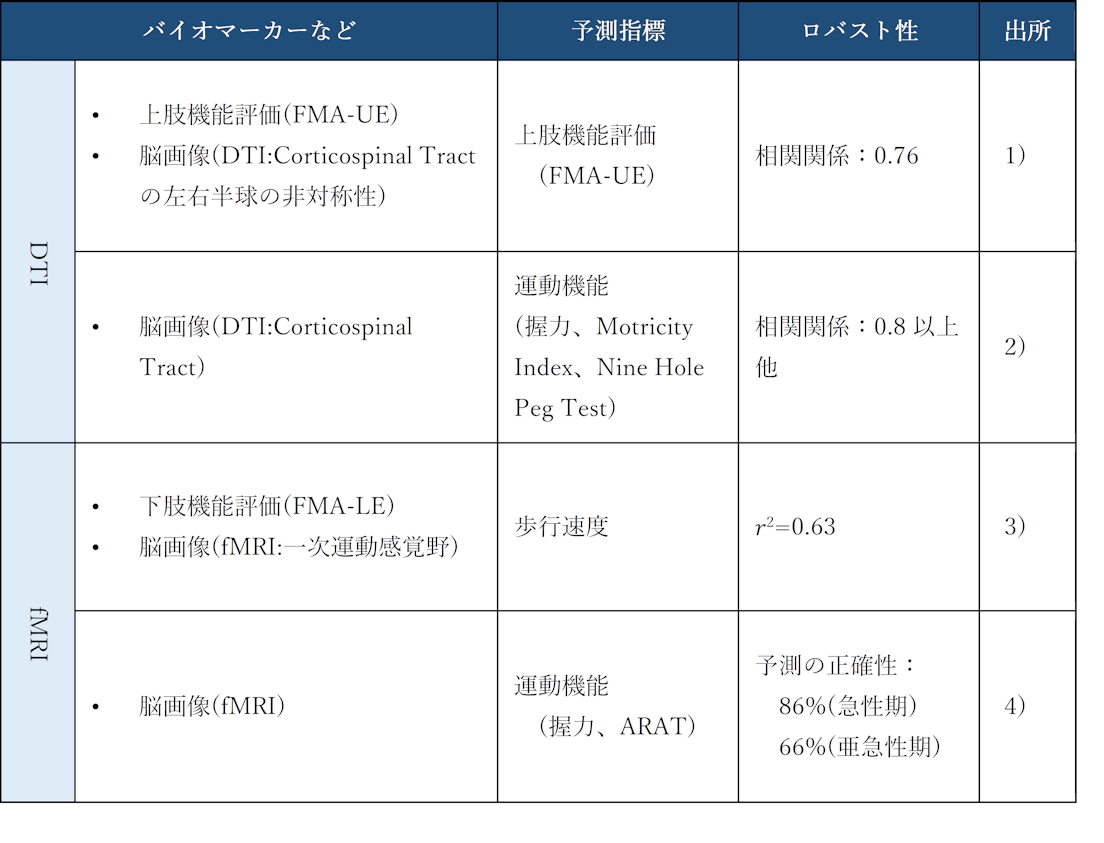
脳神経科学の知見は、まず「評価指標」の客観性の担保に貢献できると考える。近年の研究成果では、MRIによって撮像した脳画像が患者の病態とその後の回復度合いをより正確に予測するバイオマーカーとなることが分かっている23,24,25,26(表 2)。これまでの研究成果から、患者の予後予測に有効とされている脳画像は、DTIとfMRIの2つである。DTI(Diffusion Weighted Image)は、脳の神経線維の走行状態を可視化することで脳および筋間の接続性を定量評価できる。DTIから実際に発揮できる握力などを予測できる他、上肢運動機能を一定の精度で予測できることが分かっている。また、fMRI(Functional Magnetic Resonance Imaging)は、MRI機器の中で脳活動に伴う血流動態から賦活部位を同定する手法である。脳卒中後のリハビリテーションにおいては、日常生活動作を行う際に賦活する運動野の活動具合から、一定の精度でその後の運動機能や歩行速度の回復度合いを予測することが可能である。こうした客観性の高い評価を行うことで、患者毎に異なる回復度合いを予測することが可能になり、治療計画についてもカスタマイズした内容を準備できると考えられる。
表 2:脳画像を用いた定量的な予後予測
出所
1) Buch ER, Rizk S, Nicolo P, Cohen LG, Schnider A, Guggisberg AG.(2016). Predicting motor improvement after stroke with clinical assessment and diffusion tensor imaging. Neurology, 86(20):1924-5. doi: 10.1212/WNL.0000000000002675
2) Groisser BN, Copen WA, Singhal AB, Hirai KK, Schaechter JD.(2014). Corticospinal tract diffusion abnormalities early after stroke predict motor outcome. Neurorehabil Neural Repair, 28(8):751-60. doi: 10.1177/1545968314521896.
3) Burke E, Dobkin BH, Noser EA, Enney LA, Cramer SC.(2014). Predictors and biomarkers of treatment gains in a clinical stroke trial targeting the lower extremity. Stroke, 45(8):2379-84. doi: 10.1161/STROKEAHA.114.005436.
4) Rehme AK, Volz LJ, Feis DL, Eickhoff SB, Fink GR, Grefkes C.(2015). Individual prediction of chronic motor outcome in the acute post-stroke stage: Behavioral parameters versus functional imaging. Hum Brain Mapp., 36(11):4553-65. doi: 10.1002/hbm.22936.
また、多様な脳・神経の病態をデータ化し、機械学習などによって新たなサブタイプに分類することで個別化医療を可能にするアプローチ(=Computational Medicine)も急成長を遂げている。精神科領域では計算論的精神医学と呼ばれ、例えば精神統合失調症では実態として患者毎に細かな病態の違いがあっても、一律に統合失調症として取り扱われてきた中、ハプテウォルドらは患者の病態に合わせた最適な治療の提供を行えるように、2つ以上の統合失調症のサブタイプを報告した過去50件の研究を対象に系統的レビューをおこなったところ、統合失調症には2~5のサブタイプが存在することを報告している27。また、類似の事例として、機械学習によるビックデータ解析を行い、自閉症スペクトラムをいくつかのサブタイプに分類する研究も進められている28。患者のサブタイプによって、有効な治療法は異なる。このように患者の病態をきめ細かく捉えることにより、患者1人1人により適切な治療を行うことが可能になる。
最後に、「介入」有効性の担保については、脳神経の可塑性を利用した治療機器を用いた介入技術も登場している。慶應義塾大学理工学部の牛場潤一准教授は、全く手指が動かせない重度の上肢麻痺が残る脳卒中後患者に対してBMI(Brain-Machine Interface)治療機器を用いることで、失われていた腕の筋電活動を観測できることを発表している29。BMI治療機器は患者の運動意志に基づく運動野の脳波に連動して手指に装着したロボットを動作させることで、運動野の活動と手指の運動感覚が学習され、全く筋電が計測できなかった患者の一連の運動メカニズムの再獲得を支援する機能を持っている。
また、慶應義塾大学医学部の金子文成特任准教授らが開発したKiNvisTM(kinesthetic illusion induced by visual stimulation)は、手指や足関節の運動ができない片麻痺患者に自分の手指や足関節が動いている映像を見せることで、あたかも自分の意志で動かしているかのような錯覚を誘導し、その結果として運動機能の回復を実現する機器である30。本機器は、映像提示と神経筋電気刺激を反復実施する用法と、患者に随意努力をさせて適切な筋電が記録された場合に視覚フィードバックするHuman-Machine Interfaceとしての用法の2つがある。
前述の治療機器は脳波や筋電計を用いてバイオマーカーを計測して患者の微小な回復を定量的に捉えることで、いわゆる「床効果」の制約を取り払い、従来は回復が諦められていた極めて重度な片麻痺患者に対する治療を可能にしている(図 8)。
図8:脳神経再生治療機器の一例

※ 慶應義塾大学病院ウェブページ, A Case Series Clinical Trial of a Novel Approach Using Augmented Reality That Inspires Self-body Cognition in Patients With Stroke: Effects on
Motor Function and Resting-State Brain Functional Connectivity, 帝人ファーマ株式会社ウェブページを基に作成
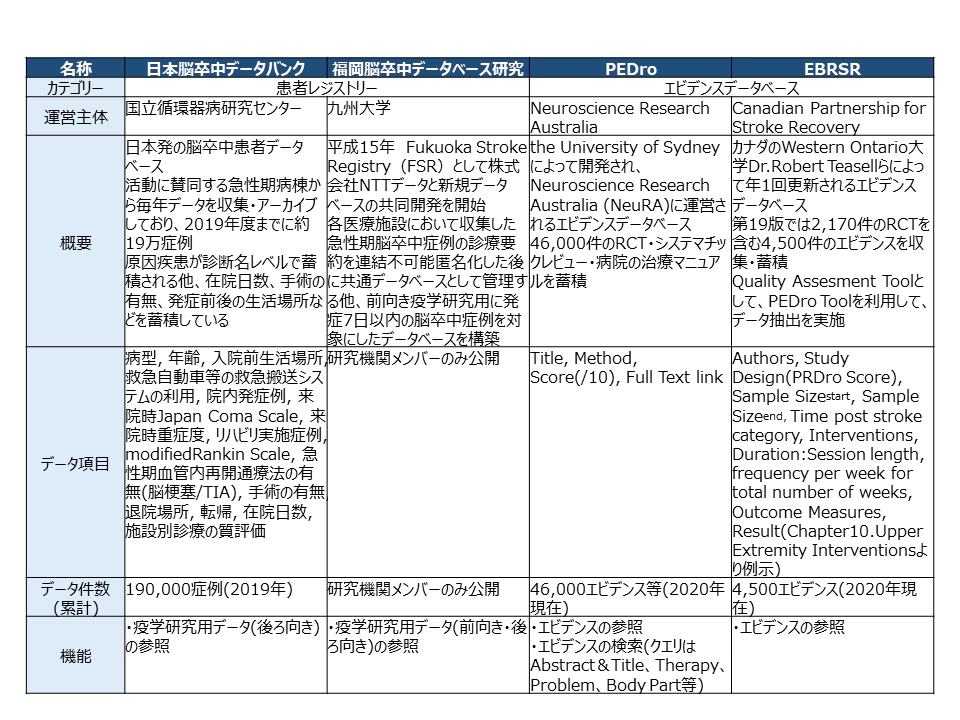
最新の研究知見の実装を支えるツールとしては、ICTなどの情報システムを基盤とした「デジタル」技術が機能する。まず、リハビリテーション現場で行われる患者の評価・介入・アウトカムを構造化して記録する機能が重要である。最新の研究知見も、患者の状態などの適用条件が正確でなければ機能しない。統計情報としての大規模データベースは国内外で構築が進められている。国内では国立循環器病研究センターが運用する15万症例以上をアーカイブした日本脳卒中データバンクや、福岡大学が開発した福岡脳卒中データベース研究などが運用されている他、民間でも独自のデータベースの蓄積を行う回復期病棟も存在する。また、最新の研究知見を蓄積したエビデンスデータベースも運用されており、カナダのウエスタン オンタリオ大学のロバート・ティーゼル博士らが年1回更新するデータベースは信頼性の高さが評価されており31、日本では畿央大学の森岡周教授、松尾篤教授が日本語訳とその公開を進めてきた32(表3)。
表3:国内外の患者レジストリー・エビデンスデータベース
こうしたデータ蓄積は現場の臨床の妨げになってはならない。そのため、リハビリテーション現場ではセラピストが20分1単位のリハビリテーションを1日18単位標準として繰り返し行う他に、治療内容の記録や病棟の医療従事者が集まって方針検討を行うカンファレンスの準備などを行う必要がある。しかし、多忙なリハビリテーション現場においては、リハビリ内容の記録は電子カルテとの二重記録などに繋がる可能性があり、業務効率化が成されなければ現場に受容されることは難しい。
リハビリテーション以外の事例になるが、簡便なデータ蓄積を実現するためにデジタル技術が活用する取り組みが進められている。パーソナルヘルスレコード事業を展開する株式会社Welbyが提供するアプリケーション“Welbyマイカルテ”は、血圧計・運動量計やメーカーも異なる複数の計測デバイスからデータを収集し、患者の健康管理に活用している点で注視すべき示唆がある33。“Welbyマイカルテ”は健康情報を患者自身が管理・運用するという思想で設計されており、2020年現在、Welbyの提供するアプリケーションは累計60万以上のダウンロードされており、国内1,000機関以上の病院・クリニックで利用されている。このアプリは特に癌治療領域において病態を患者自身に自己報告させることで、アドヒアランス(注:患者が治療方針の意思決定に参加して積極的に服薬などの治療を受けること)を高め、アウトカムとして死亡率を低下させることができるという研究成果に基づいている。“Welbyマイカルテ”の優れている点は、対象疾患である生活習慣病にとって重要な計測指標やセルフレポートをかかりつけ医に共有する作業を簡便に実現している点である。患者はスマートフォンアプリから“Welbyマイカルテ”をダウンロードした後、BluetoothやQRコード、NFCをインタフェースとして、自宅にある血圧計、血糖測定器、体重計・体組成計、活動量計などの計測機器とデータ連携することができる34(図9)。そして“Welbyマイカルテ”を導入する病院・クリニックではWeb画面で患者の日々の病態が確認できる他、食事や運動の励行状況をセルフレポートとチャット経由で確認することができる。リハビリテーションの現場においても、各メーカーの様々な計測機器や治療機器が異なるデータ構造・データ伝送方式を持っており、これまで統一的な規格でこれらの機器データの統合を行う取り組みはなされてこなかった。リハビリテーションの現場では、治療機器を用いないマニュアルセラピーも多く行われるため、音声認識技術や非接触のカメラなどのデバイスなど、一見地味だがパワフルな技術の活用を念頭にリハビリテーション内容の構造化を図る必要がある。治療内容や計測結果がデータとして取り扱えるようになると、上述の患者のサブタイプ分類のように客観性を担保した形で患者の病態を把握することができ、データドリブンな予後予測ができる可能性がある。
図9:Welbyの機器連携

※ 株式会社Welby2019年12月期決算説明資料を基に作成
最後に、デジタル技術を活用した治療提案について言及したい。回復期病棟でのリハビリテーションを終えた患者は維持期に移行し、通所リハビリテーションを受けるためにデイサービスに通う患者も多い。株式会社Rehab for JAPANがデイサービス向けに提供する「リハプラン」は、目標設定が同じ患者を自動的にグルーピングした上で、2,500種類の運動訓練から最適な組み合わせを提案するSaaS(Software as a Service)である35。介護保険領域であるデイサービスは回復期病棟とは異なり、セラピストの資格を持たない介護従事者がリハビリテーションを行う施設が少なくない。リハプランはリハビリテーションの専門家ではない人であっても的確な訓練計画を立案・実施できるように、専門家の知見から訓練マニュアルを整備・提供している。リハプランは運動訓練の支援の他にも、業務日誌・訓練記録の作成や行政から求められる計画書などの作成を簡便に行える機能も提供しており、専門知識が無くても効率的に品質の高いリハビリテーションを行うための機能が準備されている。
回復期病棟におけるリハビリテーション内容は1人1人のセラピストに一任されており、裏を返せば個々人の資質によって治療アウトカムが変動する可能性がある。まずデジタル技術を用いて実現すべきなのは、関連の協会・学会で示されているガイドラインに示される介入効果の高い治療法をセラピストがまず検討すべき介入として提示した上で、患者のサブタイプに応じて介入方法を推奨・カスタマイズする機能であり、大多数の患者向けの治療標準化と少数の患者向けの治療個別化を両立すべきと考える。また、データドリブンに期待される予後を示して実績との差分を明らかにすることで、セラピスト個々人の治療成績を明らかにするだけでなく、フィードバックループによる技能向上が期待される。
デジタル技術を用いたリハビリテーションの理想像は、人工知能などのビッグデータ解析によるアルゴリズム構築である。そもそもリハビリテーション現場では手書きの治療記録も多く、電子カルテも3割以上の施設では導入されていないことから、解析できる情報は未だ少ないのが現状である。しかし、上述のようにデジタル技術を活用することで、治療機器や複数の評価指標を1つの構造化データベースに蓄積できた場合、従来は難しかったデータドリブンアプローチが採用できる。例えば、患者のサブタイプに応じて予後予測を高精度化するだけでなく、患者の病態に合わせてより適切な治療法の提案をすることができるようになる。最終的に治療法を選定して実施するのがセラピストであることに変わりはないが、経験が浅い若手のセラピストであっても、また希少な症例の患者であっても高い品質のリハビリテーションを提供できる価値は大きい。そして何より回復を望む患者に最大の治療アウトカムを提供することができる。
データドリブンアプローチを進める上で当然であるが重要なポイントは、品質の高いデータを大量に収集した上で、一定の規格で加工・構造化することである。解析できるデータが実態を表していない品質の低いデータであったり、極めて僅少なデータであったりした場合、構築したアルゴリズムの精度は担保できない。筋電図計測をとってみても、その手続きはセラピストによって統一されていないことが多いため、標準的な計測プロトコルを整備・普及することが重要になる。また、取り扱う情報が医療情報であることを鑑みると、いわゆる三省ガイドラインに準拠した慎重な対応が必要になる。各病棟の枠組みを超えた大きなスケールで情報集約を行い、より精度の高いモデルを構築していくことが、各施設にとっても日本全体にとっても望ましい仕組みになると考えている。
6.おわりに ~Computational Rehabilitationによる個別化医療とアウトカム最大化の実現
本稿では特に国内の脳血管疾患患者を対象とした回復期におけるリハビリテーションの現状と課題、そして解決の方策について考察した。これまで医師やセラピストが磨き上げた暗黙知となっている技術が少なからず存在し、職人技の口伝に近い形で技能継承がされてきた側面がある。もちろん、それはこれまでのリハビリテーションの質を上げる原動力であったことは間違いない。
ただ、頭打ちとなっている現状を打破し、患者の誰もが個別性の高い効果的なリハビリテーション治療を受けられるようになるためには、不可知・アナログ・俗人的となっているリハビリテーションプロセスを定量化・構造化し、患者の状態と期待できる予後に合わせて個別最適な治療計画を立案・実行する、すなわち「Computational Rehabilitation」への切り替えが必要であると考える(図10)。
図10:Conputational Rehabilitationプラットフォーム構想
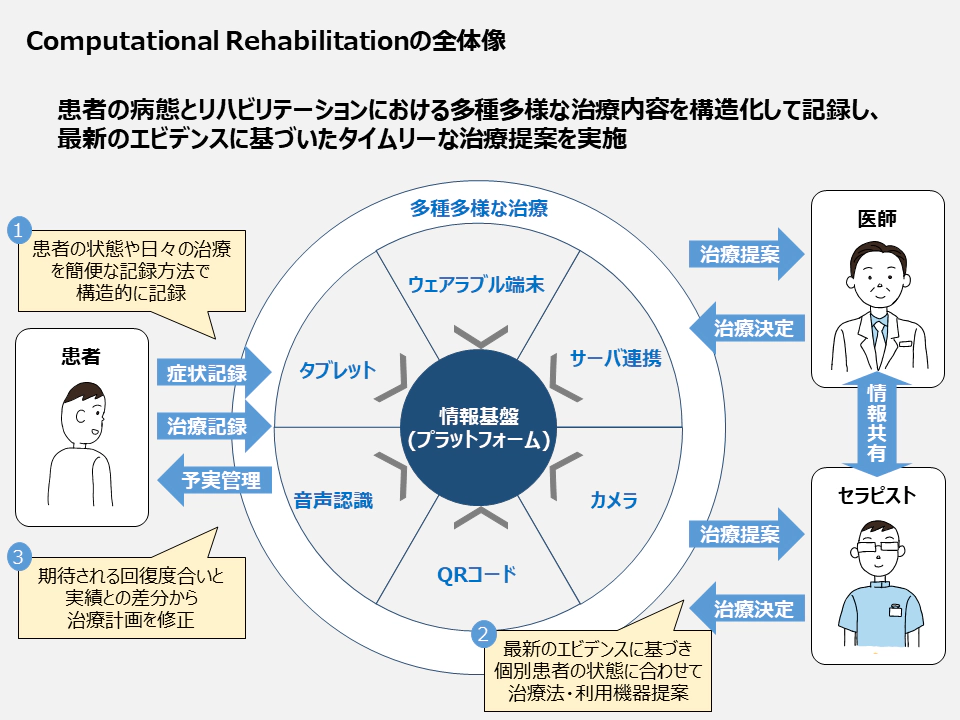
我々は、国立研究開発法人日本医療研究開発機構(以下、AMED)から補助を受け36 、パートナーの研究機関・ベンチャー企業らと共にこの「Computational Rehabilitation」の実現に向けてそのプラットフォーム開発を進めている。データの蓄積方法の標準化や一連のプラットフォームのデザインにおいて、患者や臨床機関だけでなく、学術機関や実際の機器を製造するメーカーやベンダーの個社利益追求を超えた協力を得ることが不可欠である。本稿をきっかけに同じ夢を目指すパートナーが少しでも増えることを祈って、本稿を締めくくりたい。
謝辞
本稿の執筆にあたり多大なご協力を頂いた皆様にこの場を借りて感謝申し上げます。
医療機関・研究機関・機器メーカー・医療ベンチャーの皆様には、Computational Rehabilitationの実現可能性について、時には厳しい意見をいただきながら建設的な議論とプラットフォームの仕様検討に多大なご協力をいただきました。心から感謝申し上げます。
※1
V. Feigin et al. Global, regional, and national burden of stroke, 1990 to 2016: A systematic analysis for the Global Burden of Disease study 2016. The Lancet Neurology, 2019, forthcoming
※2
厚生労働省『平成26年患者調査』
※3
厚生労働省『人口動態統計』
※4
厚生労働省『平成29年度 国民医療費の概況』
※5
厚生労働省『平成29年(2017)患者調査の概況』、厚生労働省『平成7年(1996)患者調査の概況』
※6
一般社団法人回復期リハビリテーション病棟協会『回復期リハビリテーション病棟の現状と課題に関する調査報告書』2018年
※7
厚生労働省『個別事項(その5)について, 中央社会保険医療協議会 総会(第365回)』2017年
※8
一般社団法人東京都病院協会『「回復期リハビリテーション病院機能のCI(クリニカル・インディケーター)について」事業報告書』2015年
※9
厚生労働省『令和2年度診療報酬改定について』2020年
※10
脳梗塞リハビリセンター(最終閲覧日:2020年5月16日)
https://noureha.com/
※11
神戸新聞『回復、時間制限ある公的保険に満足できず 費用かかっても自費リハビリ』2018年10月6日
※12
株式会社豊通オールライフ(最終閲覧日:2020年5月16日)
https://www.toyotsu-alllife.com/business/health/rehabilitation/
※13
促通反復療法研究所-川平先端リハラボ(最終閲覧日:2020年5月16日)
https://kawahira.org/
※14
リハプランマガジンウェブページ『FIMとは|FIMの評価方法と点数付けで知っておきたい基礎知識【総論】』(最終閲覧日:2020年5月16日)
https://rehaplan.jp/articles/338
※15
厚生労働省,中央社会保険医療協議会2019年9月5日入院分科会『診療情報・指標など作業グループにおける分析について(報告)』2019年
※16
道免 和久『脳卒中機能評価・予後予測マニュアル』医学書院、2013年
※17
Van der Vliet R, et al. Predicting Upper Limb Motor Impairment Recovery after Stroke: A Mixture Model. Annals of neurology. 2020
※18
藤田佳男、澤田辰徳『作業療法とドライブマネジメント』文光堂、2018年
※19
友利幸之介『作業療法研究のロードマップ』作業療法の実践と科学 1(4)、2019年
※20
日本脳卒中学会『脳卒中治療ガイドライン』2015年
※21
日本理学療法士学会『理学療法ガイドライン』2011年
※22
日本作業療法士協会『作業療法ガイドライン』2018年
※23
Rehme AK, Volz LJ, Feis DL, Eickhoff SB, Fink GR, Grefkes C. (2015). Individual prediction of chronic motor outcome in the acute post-stroke stage: Behavioral parameters versus functional imaging. Hum Brain Mapp., 36(11):4553-65. doi:
10.1002/hbm.22936.
※24
Burke E, Dobkin BH, Noser EA, Enney LA, Cramer SC. (2014). Predictors and biomarkers of treatment gains in a clinical stroke trial targeting the lower extremity. Stroke, 45(8):2379-84. doi: 10.1161/STROKEAHA.114.005436
※25
Groisser BN, Copen WA, Singhal AB, Hirai KK, Schaechter JD. (2014). Corticospinal tract diffusion abnormalities early after stroke predict motor outcome. Neurorehabil Neural Repair, 28(8):751-60. doi: 10.1177/1545968314521896
※26
Buch ER, Rizk S, Nicolo P, Cohen LG, Schnider A, Guggisberg AG. (2016). Predicting motor improvement after stroke with clinical assessment and diffusion tensor imaging. Neurology, 86(20):1924-5. doi: 10.1212/WNL.0000000000002675
※27
Habtewold et al., Implications of data-driven analyses for personalized therapy in psychosis: a systematic review of cluster- and trajectory-based modelling studies. bioRxiv, 2019
※28
Lombardo MV, Lai MC, Baron-Cohen S. Big data approaches to decomposing heterogeneity across the autism spectrum. Mol Psychiatry. 2019 Oct, 24(10):1435-1450.
※29
Ushiba, J. Brain-Machine Interface and Neuro-Rehabilitation. Brain and nerve. 2019
※30
Fuminari Kaneko, et al. A Case Series Clinical Trial of a Novel Approach Using Augmented Reality That Inspires Self-body Cognition in Patients With Stroke: Effects on Motor Function and Resting-State Brain Functional Connectivity.
Frontiers in Systems Neuroscience. 2019
※31
Evidence-Based Review of Stroke Rehabilitation(最終閲覧日:2020年5月16日)
https://www.google.com/search?q=Evidence-Based+Review+of+Stroke+Rehabilitation&rlz=1C1GCEU_jaJP819JP819&oq=Evidence-Based+Review+of+Stroke+Rehabilitation&aqs=chrome.0.69i59j0l6j69i61.337j0j7&sourceid=chrome&ie=UTF-8
※32
畿央大学Evidence Based Review of Stroke Rehabilitation 日本語版(最終閲覧日:2020年5月16日)
https://www.kio.ac.jp/~a.matsuo/
※33
株式会社Welby(最終閲覧日:2020年5月16日)
https://karte.welby.jp/medical/cooperation.html
※34
株式会社Welby『2019年12月期 決算説明資料』
※35
株式会社Rehab for JAPAN(最終閲覧日:2020年5月16日)
https://rehaplan.jp/training/function/
※36
国立研究開発法人日本医療研究開発機構『平成31年(令和元年)度 「先進的医療機器・システム等技術開発事業
(先進的医療機器・システム等開発プロジェクト)」の採択課題について』(最終閲覧日:2020年5月16日)
https://www.amed.go.jp/koubo/02/01/0201C_00047.html

