1.はじめに
私たちは自らの遺伝子を選べない。そのため、自分の体型や気質、がん家系ゆえに発がんリスクが高いことを「遺伝だから仕方ない」と多くの人が悩み、諦めているのではないだろうか。また、「知能は遺伝が50%、環境が50%」といったように、遺伝と環境という二つの固定化された要因がそれぞれ独立して個人の能力や形質を成り立たせていると考えている人も多いだろう。
しかし近年、遺伝要因と環境要因は互いに影響を及ぼしあいながら私たちのあり方に影響しているという考え方のもと、自らの行動や環境を変えることで、遺伝子のあなたへの影響そのもの、さらには次の代に受け継がれていく遺伝的傾向をも変えうる可能性が示され始めている1。
遺伝子・環境相互作用(GxE; Gene-environment interaction、以下 GxE)とは、前述したような、遺伝と環境の二つ因子が、ダイナミックに相互作用を起こして病気の発症や気質の発現に影響しているという考え方・研究領域である2。ある遺伝子の人は特定の環境で表現型が変わりやすく、ある環境は特定の遺伝子を持っている人に影響を与えやすい。具体的には、遺伝的に心疾患リスクの高い人であっても、生活習慣の改善(環境因子の変化)による心疾患発症率の抑制が可能であり、かつ、遺伝的なリスクが高い人ほど、その生活習慣改善によるリスク抑制の程度が大きいという研究が最近報告されている3。
昨今、個人遺伝情報の分析サービスが普及し始めているが、単純な疾患のリスク評価や、「運動・禁煙を勧める」などのありきたりな助言だけでは物足りないユーザーも多いだろう。そのような人たちへ向けて、自身の遺伝子特徴の理解だけでなく、GxE研究に基づくより自らの遺伝子に効果的な支援を行う新規事業の可能性が広がっている。本稿では、遺伝的運命に抗うGxE研究の最前線を紹介する。
2.遺伝リスクとは
本題のGxEの話題に移る前に、そもそも遺伝子や遺伝リスクとは何かということをおさらいしよう。両親から受け継ぎ、自らを構成するもととなっている遺伝子は個人によって異なる。その遺伝子の違いが、どのような病気にかかりやすいのか、どのような顔・体型になるのかなどの表現型の差異を生んでいる。なお、ここでいう遺伝リスクとは、病気や肥満などのリスクがある表現型になりやすい遺伝的傾向を指す。
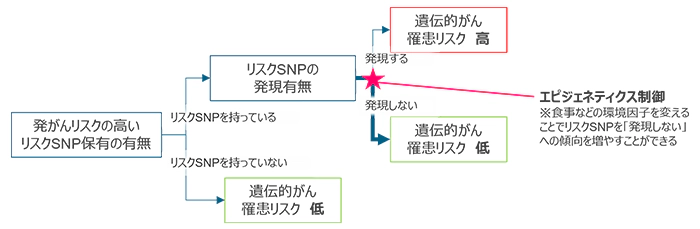
遺伝子は4種類の塩基(アデニン(A)、グアニン(G)、チミン(T)、シトシン(C))の配列からなっている。一塩基多型(SNP)とは、この遺伝子上の塩基の配列において、一つの塩基が他の人とはちがっているという状態を指している。病気の発症や肥満傾向に関係があるとされる、リスクのあるSNPのことをリスクSNPと呼び、そのリスクSNPの有無に基づいて遺伝リスクを評価する。
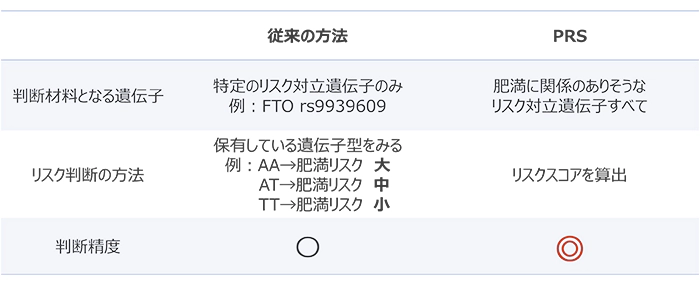
例えば、がん家系の人とそうでない人の塩基配列を比較して見つかったSNPに関して、そのSNPががんの発症有無をわけるのに貢献していると考えられるとき、そのSNPをリスクSNPと呼んでいる(図1)。このようなリスクSNPの保有の程度をもとに、大きく分けて2つの方法で遺伝リスクを測定している(表1)。
図 1:リスクSNPイメージ図

(1) 特定のリスクSNPに注目する方法(従来の方法)
これは、ある「特定」のリスクSNPに注目する方法であり、以前より使われている。たとえば、FTO rs9939609という遺伝子は肥満傾向と関係があり4、3種類の遺伝子型(AA、AT、TT)が存在する。遺伝子型によって肥満リスクが異なり、AAの人は太りやすく、ATは中間、TTは太りにくいとされている。各個人がこのFTO rs9939609に対してどの遺伝子型を保有しているかを元に、遺伝的な肥満リスクの有無を測るのである。しかし、ある表現型のリスクに対して、関係のあるとされる、特定のピックアップされたリスクSNPに注目してリスク判断を行うため、判断材料が限定的となってしまう可能性がある。
(2) 複数の遺伝子から総合的にリスク判断する方法~多遺伝子リスクスコア(PRS: Polygenic Risk Score)
2000年代後半に用いられ始めたPRS5は、従来の特定のリスクSNP保有の有無によってリスク予測する方法に比べ、より正確な表現型のリスク予測が可能6である。スコアは、疾患に関係のありそうな遺伝子を網羅的に解析したうえで、各リスクSNPがどの程度表現型のリスクに影響を与えているのかを加味したうえで算出される7。複数のリスクSNPを考慮することで、総合的なリスク判断を可能にしているのである。PRSの詳しい計算方法と、実用例については後述する。
表 1:肥満リスクを測る方法の比較
3.表現型への遺伝的なリスクは環境介入によって変えられる
(1) そもそも遺伝リスクを下げるとはどういうことか
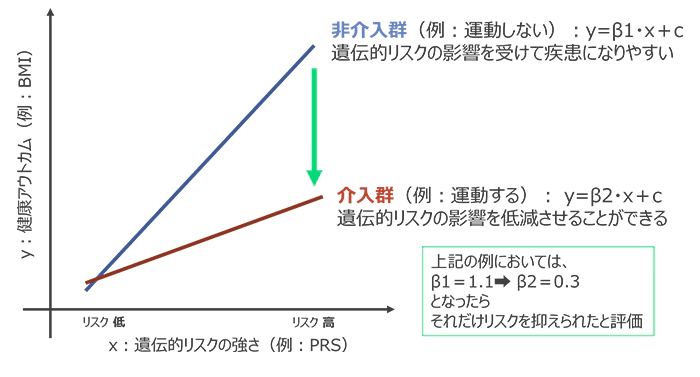
それでは本題に入ろう。遺伝リスクを下げるとは、表現型への遺伝的な影響を減らすということである。これには、実際の研究でよく用いられている評価方法8を使って説明していきたい(図2)。
図2に示したグラフでは、遺伝的な肥満リスクとBMI(Body Mass Index: 肥満度を表す指数)の関係を、運動する/しないという介入(環境因子)の有無で比較している。図からわかるように、遺伝リスクが低い被験者に関しては、介入群と非介入群でBMIにさほど差がないが、遺伝リスクが高いとき、介入群の方がBMIが低く出ている。このとき、グラフの傾きであるβが小さい介入群において、β値の低下分だけリスクを抑えられたと評価する。
図 2:GxEの解析でよく用いられる遺伝リスク低下の評価方法
(2) どのような介入がどのような影響を与えるのか
① 遺伝リスク低下が報告された介入事例
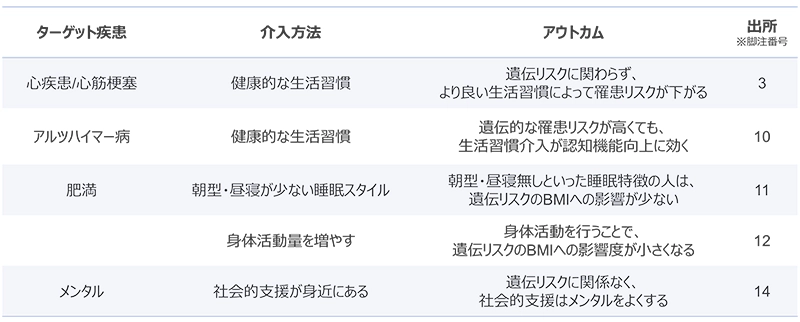
2018年に報告されたコホート研究3の結果によると、適切な食事・運動・アルコール制限・禁煙などの健康的な生活を送っていた被験者群において、遺伝的な心疾患リスクが高かったとしても、実際の罹患率が低下していたことがわかった。特に食事に関しては、野菜や魚を中心とする地中海食に近い食生活を送っている人ほど、心筋梗塞の遺伝的な影響を受けにくい9との報告もある。
さらには、アポリポタンパク質(APOE)をコードしている遺伝子において、E4という型を保有していることでアルツハイマー病の発症リスクは高まるとされているが、たとえE4保有者であったとしても、認知機能克服の可能性10が示されている。研究結果によると、健康的な生活習慣を2年間継続した結果、E4保有者も、E4非保有者である遺伝リスクの低い被験者と同じように認知機能が向上した。つまり、ハイリスクなE4を持っていたとしても、生活習慣を改善することで、ローリスクな人と同じように認知機能を維持向上できるのだ。
肥満傾向については、睡眠特徴11と身体活動量12に関する報告が上がっている。遺伝的な肥満リスクが高くても太りにくい人とは、朝型で昼寝をすることが少ない人11、かつ、運動量が多い人12であった。さらには、この運動による遺伝リスクの修正は、子供よりも大人の方が効果が大きいこともわかっている13。
加えて、メンタル状態に関しても環境因子によって遺伝因子の影響を変えられる余地がある14。うつなど多くの精神疾患に関わるセロトニンの分泌は、セロトニントランスポーター遺伝子によって調整されており、その遺伝子には3種類の遺伝子型(SS、SL、LL)が存在する。この遺伝子型によってセロトニンの分泌量も異なり、メンタル状態の傾向もわかれている。多く議論がなされているものの、最もセロトニン分泌量が少ないSS型が不安を感じやすく、SL型は中間、LL型はセロトニン分泌量が多くかつ楽観的傾向という報告が現在は主流である。
そうした遺伝子型による差があっても、「困ったときに頼れる人がいる」といった社会的支援の高い被験者群に関しては、全ての遺伝子型において、精神的回復力(レジリエンス)の向上・抑うつレベルの低下などのメンタル状態の改善が報告され、特に「LL型」の人はこの社会的支援の恩恵を預かりやすいことが分かった(図3)。
図 3:遺伝型ごとの、社会的支援レベルによるメンタル状態比較

(左:精神的回復力、右:抑うつレベル)
※14: Reinelt, E., Barnow, et al. (2015). をもとに作成
注)この研究では、LL型が最も抑うつ傾向が高い結果となり、一般に言われている結果とは逆の傾向がみられている。ここでは遺伝子型による介入(社会的支援)効果に差が報告されている事例として紹介する。
これらの研究成果からわかるように、日々の生活習慣に運動を取り入れることや、社会的な交流を持つことで、先天的な遺伝リスクを克服することができるのである(表2)。
表 2:エビデンスまとめ
② なぜ環境・行動の変化で表現型が変わるのか~後天的な遺伝子の変化:エピジェネティクス
上記のように、生まれ持った遺伝子の表現型への影響は行動や環境で変えうることができる。では、何がそのような変化を起こしているのだろうか。そのヒントは遺伝子への後天的な修飾によるリスクSNPの活動性の変化にあるかもしれない。そういった研究成果も報告され始めている。
遺伝子には、実際に発現するものと、発現せずに不活性化し、「保有しているが働いていない状態」となるものの2種類がある。その遺伝子の発現を調整することがエピジェネティクス制御、つまり後天的な要因により遺伝子発現のオン・オフのスイッチを入れるメカニズムであり、DNAのメチル化とヒストンの修飾により行われている15(図4)。
そしてそのエピジェネティックな変化は、どのような食生活やストレス環境で過ごしているかといった環境要因で変化する。つまりDNAの塩基配列自体の変化を伴わないものの、環境因子の変化によって遺伝子を不活性化させるエピジェネティックな変化がおき、表現型にも影響してくるのだ。さらに、そういった環境因子による遺伝子活動性の変化は次世代へと受け継がれる16ことも示唆されている。
図 4:リスク遺伝子の表現型に影響を与えるまでのフローチャート
エピジェネティクスと食生活による発がんリスクの調整に関して行われたレビュー17では、ビタミンBの一部である葉酸やコバラミン、ポリフェノール、野菜、果物の摂取が、がんのリスクSNPを含む発がん性遺伝子への修飾を変化させ、ひいては遺伝子の発現を抑制し、結果としてがん罹患リスクを下げることが報告されている(図5)。健康的な食事によって、どのような遺伝子が活発化/不活性化するかを再編することが可能であり、結果として特定の疾患を予防できることを示唆するものである。
他にも、精神疾患の改善にエピジェネティックな変化が連動していることを示す研究も報告されている18。モノアミン酸化酵素(MAO)という精神疾患との関連性が報告されている酵素に関して、そのモノアミン酸化酵素の作用を抑制するDNAメチル化が、パニック障害患者は健常者よりも少ない。しかし、6週間の認知行動療法(ものの受け取り方や考え方を変えて気持ちを楽にすることを目指す精神療法)を行うことで、そのDNAメチル化が健常者と同程度まで上昇した。このように6週間という短期間の行動変容でも遺伝子の働きは変わりうるのである。
図 5:食事介入による発がん性遺伝子の活動性制御

4.自社データを用いた「情緒不安定性」を例にした分析の実践例
NTTデータ経営研究所では5万人にのぼる様々な個人特性をWEB上で収集した「人間情報データベース」というリサーチパネルを保有している。
(https://www.nttdata-strategy.com/services/advanced_technology/human_information.html)
その登録者905人の同意を得て、1376のSNP情報(協力:ジェノプラン社 https://www.genoplan.com/jp/)と「情緒不安定性(落ち込みやすいなど感情面・情緒面で不安定な傾向)」に関する遺伝因子と環境因子について実際に解析を行った。情緒不安定になりやすい性格であることは、抑うつ状態などの精神疾患をかかえる可能性が高いことが知られている19。そのため情緒不安定性を改善することは、メンタルヘルスの改善にもつながることが期待される。
以下に解析の詳細を記す。
(1) PRS(遺伝的リスクスコア)の算出
① PRS計算手法
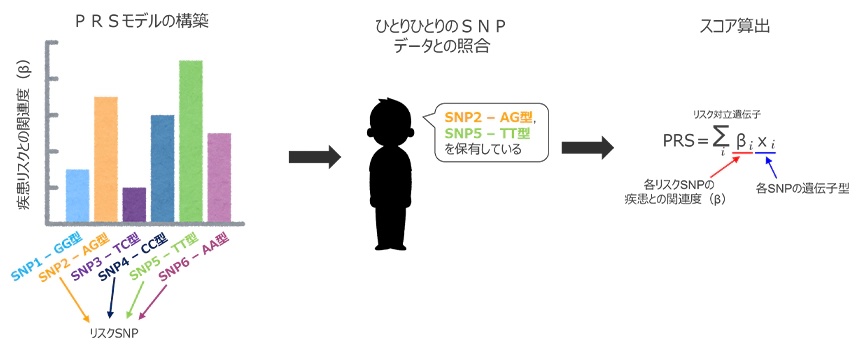
PRSは、大きく分けて以下の3つのステップを踏んで計算した(図6)。
- PRSモデルの構築:どのSNPがどの程度疾患リスクに貢献しているのかを測る全員分のSNPを予測子に、情緒不安定性を目的変数とした回帰モデルを学習させ、個々のSNPがどれだけ情緒不安定性に影響を与えているのかを係数β値で評価できるようにした。具体的には、100分割交差検定によるLASSO回帰モデルを用い、予測に関係のない予測子は排除した。
- ひとりひとりのSNPデータとの照合:個人がどのリスクSNPを保有しているかを照合
- スコア計算
リスクSNPをPRSモデルの係数β値で重みづけし、リスクスコアを算出する20。
図 6:PRSの計算方法
② 情緒不安定性を予測するPRSモデルの結果
情緒不安定性の遺伝リスク予測因子となったリスクSNPは全部で93あった。その中にはrs2964802など、うつとの関連性が報告されている21遺伝子も含まれていた。rs2964802は比較的β値も高く(β=0.18)、より情緒不安定性の表現型に関連していると考えられる。rs2964802遺伝子にはTT、CT、CCの3種類の遺伝子型が存在しており、TT、CTの遺伝子型と比較して、CCが情緒不安定に最もなりやすく、このCC型が情緒不安定性のリスクSNPのひとつであることがわかった(p=0.02)(図6左)。また、選出されたリスクSNPをもとに算出したPRSによる情緒不安定性の予測精度は予実相関で0.58であった(図7右)。
図 7: PRS計算結果
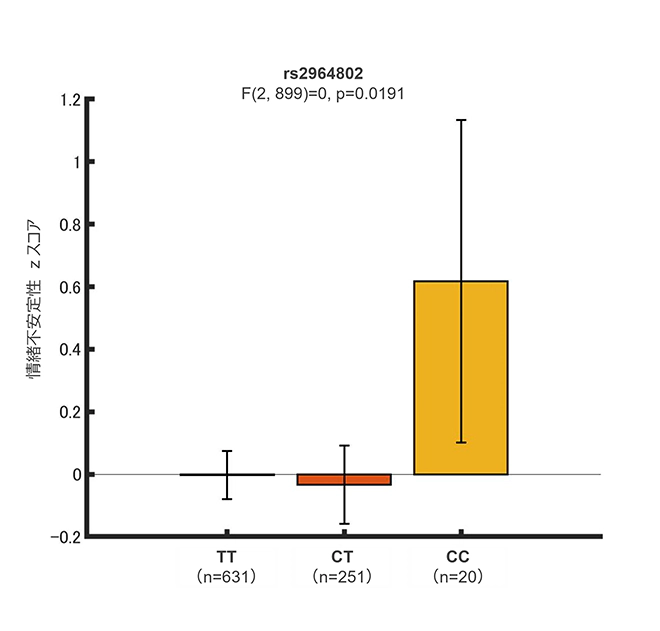
左:rs2964802の遺伝子型による情緒不安定性の比較
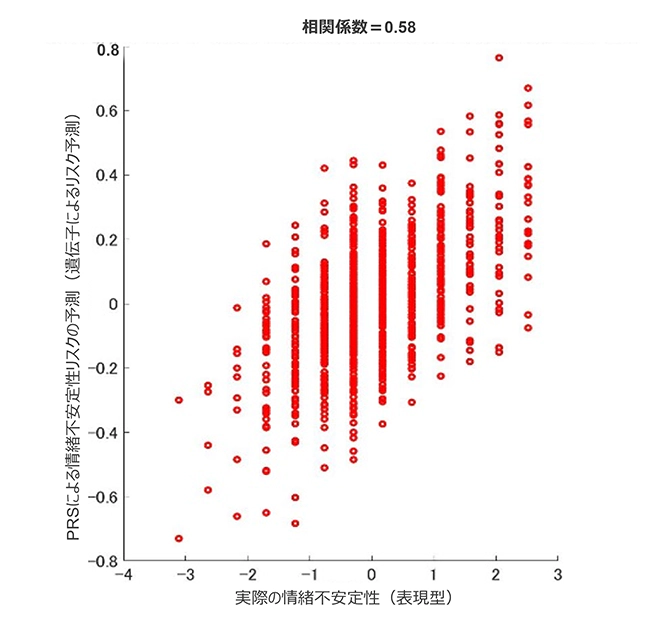
右:被験者ごとのPRSによる予測結果と実際の情緒不安定性(相関係数=0.58)
(2) GxE解析
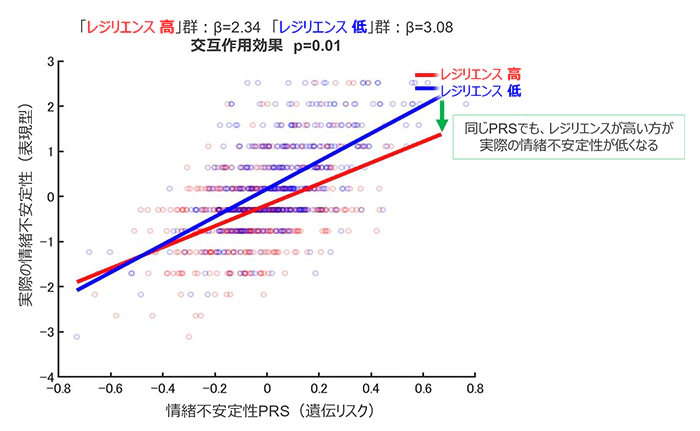
情緒不安定性のPRS(遺伝リスク)と実際の情緒不安定性(表現型)との関係性に、環境因子(人間情報データベースに登録されている変数)による差がでるかを調べたところ「情緒不安定性のPRS」×「レジリエンスの高さ(ストレス状況に対してうまく適応・対処できる能力)」に交互作用効果があることがわかった(p=0.01)。つまり、情緒不安定性のPRS(G:遺伝因子)が実際の情緒不安定性へ与える影響が、レジリエンスの高さ(E:環境因子)によって修正されていたと解釈できる。
PRSが高い人において、レジリエンスが高いグループの人の方が、レジリエンスが低いグループの人よりも実際の情緒不安定性が低くなっていた(図8)。このことより、レジリエンスを高めることで、情緒不安定性の遺伝的なリスクを減らすことができることが示唆される。
図 8:レジリエンスの強さによる情緒不安定性の遺伝的影響の比較
(3) 有望な介入方法〜レジリエンスを上げるには?
① レジリエンスを上げるための方法
では、どのようにしてレジリエンスを高めたらいいのだろうか。「感情の言語化」はレジリエンス強化の方法のひとつとして報告されている22。蜘蛛やケガといった嫌悪感を誘発する写真を見せたときの心拍や発汗などの反応を調べた実験では、写真と同時にネガティブさを表すキーワードを文字で表示させることで、写真への反応性が下がった。
つまり、ストレスなどの刺激に対する自分のリアクションを言語化してあげることが、レジリエンス強化につながるのである。他にも、日々自分が大切にしたい価値観を意識して生活することもレジリエンス向上につながってくる23。
例えば「知識を習得する」のような行動目標が自分にとってどのくらい価値があるのか、そしてその目標達成のための行動をどの程度とることができたかといった質問に回答して算出された「価値ある生活スコア」をレジリエンスの高さで比較した研究では、その「価値ある生活スコア」が高い人ほど、レジリエンスが高いという結果が得られた。さらには、瞑想24、朝型の生活25、7~8時間程度の適度な睡眠26、有酸素運動26、栄養を損なわない範囲での食事制限26などもレジリエンス強化に効果があるとの報告がされている。
このように、GxE解析で介入すべき変数が特定できれば、さまざまな介入を選択肢として提供することが可能となる。
② レジリエンス強化とエピジェネティクスの変化
ストレス環境・レジリエンスに関わるエピジェネティックレベルでの変化も多数報告27されている。
日常的に感じるストレスと、セロトニントランスポーター遺伝子を抑制するDNAメチル化の変化を調べた研究では、ストレスレベルによってDNAメチル化量が変化しうることが分かっている。また、ストレスへの回復力を指すレジリエンスの表現型に関しても、レジリエンスの高いマウスと低いマウスとではDNAメチル化の量に差があることがわかっている28。そのため、レジリエンスの差を生み出すエピジェネティックな観点にも注目し、どの遺伝子型を持っている人がどのような環境変化でレジリエンスが向上するのかといった研究の観点も有益だと言えるだろう。
5.氏や育ちであなたの運命は決まらない ~本人が選択できない「環境」によるエピジェネティックな悪影響も回復可能
これまで見てきたように、生まれ持った遺伝的な影響は行動や環境次第で変わりうる。
一方で「環境」も容易に選べるものでもない。虐待のある家庭や、ハラスメントのある職場に置かれている人はその環境を自ら変えることは容易ではないはずだ。そして悲しいことに、こうしたストレス環境に身を置くことは、精神疾患リスクという点に関して、エピジェネティックに「悪い」影響をもたらしうる。けれど、そのような過去の経験に基づくエピジェネティクスへの影響さえも、介入によってあとから回復できる可能性が示唆されている。
例えば幼少期の家庭環境29や職場の環境30によって生じる避けがたいストレスが原因となって、精神疾患リスクを高めるエピジェネティックな変化(DNAメチル化)が起こってしまうことがある。しかし、そのようにして一度起こったエピジェネティクス変化を、後から修正できることも分かってきた。2020年に発表されたレビュー31の中で、不安症を抱えている患者を対象に行われた認知行動療法の治療介入実験と、セロトニントランスポーター遺伝子へのDNAメチル化の変化を調べた実験が紹介されている。
この研究によると、6ヶ月間の治療介入を経て、治療効果がみられた人において、DNAメチル化が介入前より有意に増えていた。このように精神疾患を患っていたとしても、認知行動療法のような介入によって、DNAレベルで精神疾患を緩和させる変化を起こさせることができるのである。加えて、心理セラピーやマインドフルネスなどもエピジェネティクス修正に有効な介入として紹介されている。
氏も育ちも変えられない運命ではないのだ。
6.GxEの先にある個人最適化~個人の遺伝特徴ごとに、効果的な介入を知る
ここ数年で、各個人が保有する遺伝的傾向の特徴抽出、またその遺伝的傾向を克服するための介入について数多くの研究がなされてきた。では、どのような介入が自分には最も効果的なのだろうか。個人の遺伝情報と環境の相互作用を知ることでさらに可能になってくるのが、「どの遺伝子型を持つ人が、どのような行動をとると、目標とする表現型の変化が起こせるのか」という個人への介入の最適化、つまりはパーソナライズの実現だ。
例えば日常的に感じるストレスによる、セロトニントランスポーター遺伝子を抑制するDNAメチル化の仕方は、セロトニントランスポーター遺伝子の遺伝子型によって差があることがわかっている32。そのため、遺伝子型に応じて異なるストレス対処法が必要になってくるだろう。
他にもうつ病治療に関して、セロトニントランスポーター遺伝子におけるDNAメチル化量の個人差が、抗うつ薬の有効性についての個人差に影響している33ことがわかっている。うつ病患者を対象とした6週間の抗うつ薬摂取経過観察の結果、セロトニントランスポーター遺伝子の発現を抑制するDNAメチル化が低レベルの患者には抗うつ薬が効かなかった。
このように、遺伝子の個人特性に応じ、より効果的な介入方法を探していくことも可能である。個人の遺伝的特性の分析と効果的な介入方法を模索していくことは、最適ながん予防、ダイエット、認知機能の向上、精神疾患治療などの提案に役立つはずだ。
7.おわりに
本稿では、遺伝子による疾患や肥満などの先天的なリスクが、後天的な介入によって修正できる可能性について紹介してきた。
遺伝リスクを克服するまでには、
① 遺伝リスクを知る
② 介入方法を知る
の大きく分けてふたつのステップがある(図9)。
まずリスクSNPの有無をもとにPRSなどによって遺伝リスクを測る。この結果により遺伝リスクが高いことが分かった場合、そのリスクの高い遺伝子の活動性を変え得る環境因子を操作する。精神疾患リスクを高めるDNAメチル化を減らすためのストレス環境を整えるといった介入はここにあたる。ここでポジティブな環境を作ることができれば、リスクSNPを不活性化させるようなDNAメチル化の変化を促し、結果としてうつリスクの低い健康なメンタル状態へとつなげることができる。
逆に、家庭環境や職場の問題等でそもそもストレス負荷の大きい環境にさらされていた場合、リスクSNPは活性化し、結果としてうつリスクを高めてしまうこともある。しかし、介入②にあるようなマインドフルネスや認知行動療法を通じて、これらのリスクSNPを不活性化させるようなエピジェネティックの修正も可能である。
図 9:遺伝リスク克服までのフロー
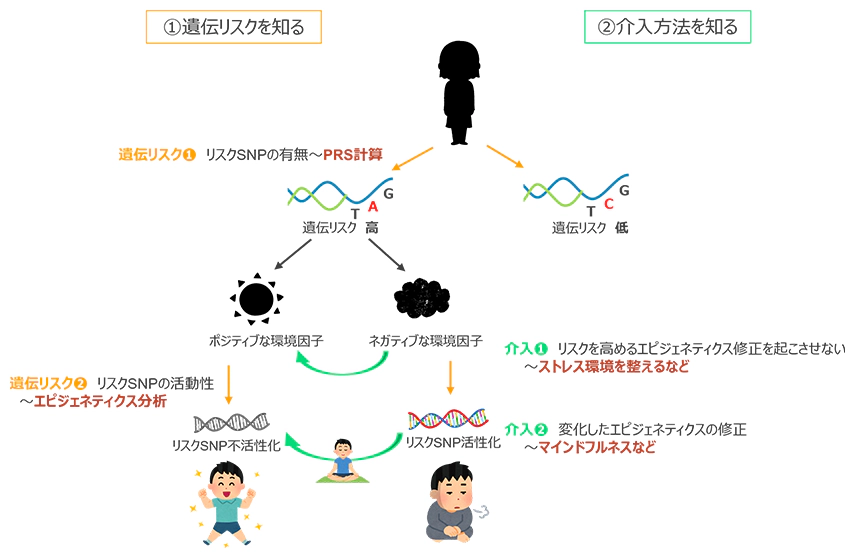
このようにして、自分の遺伝子および環境状態の把握とそれをもとにした適切な介入を通じて、メンタルおよびフィジカルともに、より健康な体へと導くことが可能となる。こうしたことを支援するサービスはまだ市場ができていないが、ニーズは大きいのではないだろうか。
生まれ持った遺伝子や置かれた環境を変えるのは確かに難しいかもしれない。
また、遺伝的な傾向は受け入れざるを得ないと思っている人、過去のトラウマに捕らわれている人も多いのではないだろうか。
しかし今回紹介したようなGxEの科学は、これからの人生は変えられることを明確に示している。あなたが望めばもっと健康になれるし、幸福にもなれる。
変えられない遺伝子や過去に縛られることなく、なりたい未来の自分を思い描いている人を支援するような事業が現れることを期待して、本稿を締めくくりたい。
1Jin, G., Lv, J., Yang, M., Wang, M., Zhu, M., Wang, T., ... & Li, L. (2020). Genetic risk, incident gastric cancer, and healthy lifestyle: a meta-analysis of genome-wide association studies and prospective cohort study. The Lancet Oncology, 21(10), 1378-1386.
2Ottman, R. (1996). Gene–environment interaction: definitions and study design. Preventive medicine, 25(6), 764-770.
3Pazoki, R., Dehghan, A., Evangelou, E., Warren, H., Gao, H., Caulfield, M., ... & Tzoulaki, I. (2018). Genetic predisposition to high blood pressure and lifestyle factors: associations with midlife blood pressure levels and cardiovascular events. Circulation, 137(7), 653-661.
4Kilpeläinen, T. O., Qi, L., Brage, S., Sharp, S. J., Sonestedt, E., Demerath, E., ... & Loos, R. J. (2011). Physical activity attenuates the influence of FTO variants on obesity risk: a meta-analysis of 218,166 adults and 19,268 children. PLoS medicine, 8(11), e1001116.
5Wray, N. R., Goddard, M. E., & Visscher, P. M. (2007). Prediction of individual genetic risk to disease from genome-wide association studies. Genome research, 17(10), 1520-1528.
6Fahed, A. C., Wang, M., Homburger, J. R., Patel, A. P., Bick, A. G., Neben, C. L., ... & Khera, A. V. (2020). Polygenic background modifies penetrance of monogenic variants for tier 1 genomic conditions. Nature communications, 11(1), 1-9.
7Fahed, A. C., Wang, M., Homburger, J. R., Patel, A. P., Bick, A. G., Neben, C. L., ... & Khera, A. V. (2020). Polygenic background modifies penetrance of monogenic variants for tier 1 genomic conditions. Nature communications, 11(1), 1-9.
8Celis‐Morales, C. A., Lyall, D. M., Bailey, M. E., Petermann‐Rocha, F., Anderson, J., Ward, J., ... & Gray, S. R. (2019). The combination of physical activity and sedentary behaviors modifies the genetic predisposition to obesity. Obesity, 27(4), 653-661.
9Leu, H. B., Chung, C. M., Chen, J. W., & Pan, W. H. (2019). The Mediterranean diet reduces the genetic risk of chromosome 9p21 for myocardial infarction in an Asian population community cohort. Scientific reports, 9(1), 1-8.
10Solomon, A., Turunen, H., Ngandu, T., Peltonen, M., Levälahti, E., Helisalmi, S., ... & Kivipelto, M. (2018). Effect of the apolipoprotein E genotype on cognitive change during a multidomain lifestyle intervention: a subgroup analysis of a randomized clinical trial. JAMA neurology, 75(4), 462-470.
11Solomon, A., Turunen, H., Ngandu, T., Peltonen, M., Levälahti, E., Helisalmi, S., ... & Kivipelto, M. (2018). Effect of the apolipoprotein E genotype on cognitive change during a multidomain lifestyle intervention: a subgroup analysis of a randomized clinical trial. JAMA neurology, 75(4), 462-470.
12Reddon, H., Gerstein, H. C., Engert, J. C., Mohan, V., Bosch, J., Desai, D., ... & Meyre, D. (2016). Physical activity and genetic predisposition to obesity in a multiethnic longitudinal study. Scientific reports, 6(1), 1-10.
13Kilpeläinen, T. O., Qi, L., Brage, S., Sharp, S. J., Sonestedt, E., Demerath, E., ... & Loos, R. J. (2011). Physical activity attenuates the influence of FTO variants on obesity risk: a meta-analysis of 218,166 adults and 19,268 children. PLoS medicine, 8(11), e1001116.
14Reinelt, E., Barnow, S., Stopsack, M., Aldinger, M., Schmidt, C. O., John, U., & Grabe, H. J. (2015). Social support and the serotonin transporter genotype (5‐HTTLPR) moderate levels of resilience, sense of coherence, and depression. American Journal of Medical Genetics Part B: Neuropsychiatric Genetics, 168(5), 383-391.
15What is Epigenetics? | CDC. (2020, August 3). Centers for Disease Control and Prevention. https://www.cdc.gov/genomics/disease/epigenetics.htm
16Nono, M., Kishimoto, S., Sato-Carlton, A., Carlton, P. M., Nishida, E., & Uno, M. (2020). Intestine-to-germline transmission of epigenetic information intergenerationally ensures systemic stress resistance in C. elegans. Cell reports, 30(10), 3207-3217.
17Abdul, Q. A., Yu, B. P., Chung, H. Y., Jung, H. A., & Choi, J. S. (2017). Epigenetic modifications of gene expression by lifestyle and environment. Archives of pharmacal research, 40(11), 1219-1237.
18Ziegler, C., Richter, J., Mahr, M., Gajewska, A., Schiele, M. A., Gehrmann, A., ... & Domschke, K. (2016). MAOA gene hypomethylation in panic disorder—reversibility of an epigenetic risk pattern by psychotherapy. Translational Psychiatry, 6(4), e773-e773.
19Shi, J., Yao, Y., Zhan, C., Mao, Z., Yin, F., & Zhao, X. (2018). The relationship between big five personality traits and psychotic experience in a large non-clinical youth sample: the mediating role of emotion regulation. Frontiers in psychiatry, 9, 648.
20Khera, A. V., Chaffin, M., Aragam, K. G., Haas, M. E., Roselli, C., Choi, S. H., ... & Kathiresan, S. (2018). Genome-wide polygenic scores for common diseases identify individuals with risk equivalent to monogenic mutations. Nature genetics, 50(9), 1219-1224.
21Hall, L. S., Adams, M. J., Arnau-Soler, A., Clarke, T. K., Howard, D. M., Zeng, Y., ... & McIntosh, A. M. (2018). Genome-wide meta-analyses of stratified depression in Generation Scotland and UK Biobank. Translational psychiatry, 8(1), 1-12.
22Tabibnia, G., Lieberman, M. D., & Craske, M. G. (2008). The lasting effect of words on feelings: words may facilitate exposure effects to threatening images. Emotion, 8(3), 307.
23Ceary, C. D., Donahue, J. J., & Shaffer, K. (2019). The strength of pursuing your values: Valued living as a path to resilience among college students. Stress and Health, 35(4), 532-541.
24Hwang, W. J., Lee, T. Y., Lim, K. O., Bae, D., Kwak, S., Park, H. Y., & Kwon, J. S. (2018). The effects of four days of intensive mindfulness meditation training (Templestay program) on resilience to stress: a randomized controlled trial. Psychology, health & medicine, 23(5), 497-504.
25Tafoya, S. A., Aldrete–Cortez, V., Ortiz, S., Fouilloux, C., Flores, F., & Monterrosas, A. M. (2019). Resilience, sleep quality and morningness as mediators of vulnerability to depression in medical students with sleep pattern alterations. Chronobiology international, 36(3), 381-391.
26Tabibnia, G., & Radecki, D. (2018). Resilience training that can change the brain. Consulting Psychology Journal: Practice and Research, 70(1), 59.
27Gottschalk, M. G., Domschke, K., & Schiele, M. A. (2020). Epigenetics underlying susceptibility and resilience relating to daily life stress, work stress, and socioeconomic status. Frontiers in psychiatry, 11, 163.
28Cadet, J. L. (2016). Epigenetics of stress, addiction, and resilience: therapeutic implications. Molecular neurobiology, 53(1), 545-560.
29Parade, S. H., Huffhines, L., Daniels, T. E., Stroud, L. R., Nugent, N. R., & Tyrka, A. R. (2021). A systematic review of childhood maltreatment and DNA methylation: candidate gene and epigenome-wide approaches. Translational psychiatry, 11(1), 1-33.
30Alasaari, J. S., Lagus, M., Ollila, H. M., Toivola, A., Kivimäki, M., Vahtera, J., ... & Paunio, T. (2012). Environmental stress affects DNA methylation of a CpG rich promoter region of serotonin transporter gene in a nurse cohort. PLoS One.
31Schiele, M. A., Gottschalk, M. G., & Domschke, K. (2020). The applied implications of epigenetics in anxiety, affective and stress-related disorders-A review and synthesis on psychosocial stress, psychotherapy and prevention. Clinical psychology review, 77, 101830.
32Gottschalk, M. G., Domschke, K., & Schiele, M. A. (2020). Epigenetics underlying susceptibility and resilience relating to daily life stress, work stress, and socioeconomic status. Frontiers in psychiatry, 11, 163.
33Domschke, K., Tidow, N., Schwarte, K., Deckert, J., Lesch, K. P., Arolt, V., ... & Baune, B. T. (2014). Serotonin transporter gene hypomethylation predicts impaired antidepressant treatment response. International Journal of Neuropsychopharmacology, 17(8), 1167-1176.

